Fauna de Lepidoptera, Saturniidae y Sphingidae,
del Refugio Biológico Carapa
en el Departamento de Kanindejú, Paraguay
ULF DRECHSEL
ABSTRACT - A checklist of moths families Saturniidae and Sphingidae, which were observed in Refugio Biológico Carapa, is given. Within a period of ten years the protected area was visited eight times and 37 species of silkmoths and 48 of hawkmoths were recorded. Geografic distribution is commented and tables of temporal distribution and frequency of annual observation are added. An image gallery of 29 species of saturnids and 33 of sphingids is annexed.
RESUMEN - Se presenta un inventario de Saturniidae y Sphingidae que habitan en el Refugio Biológico Carapa. Durante ocho visitas al área en un periodo de diez años fueron registrados 37 especies de Saturniidae y 48 especies de Sphingidae. Se comenta la distribución geográfica de cada especie. Se agrega cuadros de distribución temporal y frecuencia anual de observación de las especies y 70 fotografías de 29 especies de Saturniidae y 33 de Sphingidae.
INTRODUCCIÓN
El desconocimiento de los componentes de la fauna de los Saturniidae y Sphingidae de Paraguay se refleja en la escasez de publicaciones que se dedican al tema (Schade, 1927, 1928; Drechsel, 1994, 1995 y Racheli, 1995). En una lista preliminar, Drechsel (1994) menciona 83 especies de Sphingidae encontrados hasta entonces en el país. Un inventario de los Saturniidae está en elaboración.
En todo el Paraguay se registraron hasta el momento 91 especies de Saturniidae y también 91 de Sphingidae, de las cuales 37 y 48 respectivamente fueron encontradas en el refugio.
ÁREA DE ESTUDIO
El estudio se realizó en el Refugio Biológico Carapa, en el departamento de Kanindeyú, ubicado al margen derecho del Río Paraná, embalsado por la represa de Itaipu, a 220-300 msnm. El refugio cuenta con 3250 ha, principalmente de bosques nativos, pero alterados y desprovistos de gran parte de su estrato alto. No obstante se conserva una gran diversidad de árboles, porque se extrajo solo unas pocas especies con fustes maderables. El suelo, derivado de rocas basálticas, tiene una textura arcillosa. El clima es subtropical, calido, húmedo, con una precipitación anual promedio de 1300 mm.
Debido a la fertilidad de los suelos, toda la zona que una vez cubrió el Bosque Atlántico esta ampliamente deforestada para hacer lugar a cultivos, en especial para la soja. Asimismo se deforestó y sigue deforestando paulatinamente toda la zona alrededor del refugio.
MÉTODOS
El área del estudio fue visitado en ocho ocasiones durante los últimos diez años: del 28. al 30. de Marzo 1997, de 1. al 4 de Abril 1998, del 24. al 30. Noviembre 1998, del 21. al 25. Abril 1999, del 14. al 20. Agosto 2000, del 20. al 26. Noviembre 2003, del 14. al 19. Marzo 2005 y del 28. Agosto al 6. Setiembre 2006.
Debido a los hábitos nocturnos de casi la totalidad de las especies tratadas, las observaciones se centraron en las inmediaciones de la administración de la reserva, ubicada en 24º 22,4´ latitud Sur y 54º 22,7´ longitud Oeste, por la disponibilidad de energía eléctrica. Dos focos de luz mixta de 250 W cada uno fueron utilizados durante 47 noches para atraer insectos. Además se controló las luces en las paredes exteriores de los edificios de la administración. La búsqueda de larvas durante el día dio pocos resultados, porque la gran mayoría de orugas encontradas resultaron ser parasitadas o el tiempo de estadía no alcanzó para completar el ciclo. Mejor resultado arrojó la técnica de encerrar hembras con el propósito de obtener huevos fecundados de ellas. Con la planta forrajera natural o un substituto de la misma se logró criar varias especies en el laboratorio.
Ejemplares testigos se encuentran en la colección del Museo de la Itaipu Binacional en Hernandarias, Alto Paraná.
LISTA DE ESPECIES
SATURNIIDAE
ARSENURINAE
Arsenura armida (Cramer, 1779) fig. 1
Ampliamente distribuida en Centro- y Sudamérica (Lemaire, 1980). En Paraguay se encuentra en toda la zona que una vez cubrió el Bosque Atlántico. En Carapa común y las larvas gregarias fueron encontradas sobre Luehea divaricata (Tiliaceae) y Bastardiopsis densiflora (Malvaceae).
Arsenura xanthopus (Walker, 1855) fig. 2
Esta especie se encuentra solamente en el Sureste de Brasil (Lemaire, 1980) y en Paraguay en el Este del país.
Dysdaemonia brasiliensis W. Rothschild, 1906 fig. 3
Conocida solo del Sureste de Brasil (Lemaire, 1980) y del este de Paraguay donde abarca toda la zona que una vez cubrió el Bosque Atlántico. Las larvas solitarias sobre Ceiba speciosa (Bombacaceae).
Dysdaemonia fosteri W. Rothschild, 1906 fig. 4
Su distribución abarca todo el Paraguay hasta las partes subandinas entre Bolivia y Argentina. Las larvas viven solitarias y se alimentan de diferentes especies de Ceiba.
CERATOCAMPINAE
Citheronia laocoon (Cramer, 1777) fig. 5
Desde el Sur de la región amazónica hasta el Norte de Argentina y Uruguay. Especie común en todo el este de Paraguay, en carapa observado en una sola ocasión. Las larvas solitarias fueron criadas exitosamente sobre Terminalia catappa (Combretaceae).
Schausiella arpi (Schaus, 1892)
Sureste de Brasil (Lemaire, 1988) y Norte y Este de Paraguay, donde parece ser elemento del Cerrado y de los bosques secos del Norte. Una sola vez observado en el Refugio.
Syssphinx molina (Cramer, 1780) fig. 6 y 7
Ampliamente distribuida en Centro- y Sudamérica (Lemaire, 1988). Común en todo el Este de Paraguay y en partes del Chaco húmedo. Las larvas solitarias se encuentran sobre muchas plantas leguminosas como Pithecollobium spp., Albizzia sp., Cassia spp. y otros.
Adeloneivaia subangulata (Herrich-Schäffer, [1855]) fig. 8 y 9
Distribuida desde Costa Rica hasta Paraguay con excepción de la selva amazónica y el seco Nordeste de Brasil. A. subangulata es la especie mas común en la parte oriental del Paraguay y en el Chaco húmedo. Larva solitaria sobre Acacia spp. (Fabaceae).
Adeloneivaia acuta (Schaus, 1896)
Desde Venezuela hasta Paraguay y el Sureste de Brasil, excluyendo la Amazonía. Común en Carapa, pero muy raro y con pocos registros en el resto del país.
Adelowalkeria flavosignata (Walker, 1865) fig. 10
Distribución parecida a la de la especie anterior. Muy común en el Refugio. La larva solitaria fue encontrada en dos ocasiones sobre Machaerium sp. (Fabaceae) y una especie no identificada de Euphorbiaceae.
Scolesa hypoxantha (W. Rothschild, 1907) fig. 11
Desde el Sur del Amazonas hasta la provincia de Tucumán en Argentina y el Sureste de Brasil, incluyendo todo el Paraguay. En dos ocasiones fue observada en el Refugio.
Citioica anthonilis (Herrich-Schäffer, [1854]) fig. 12
La especie se encuentra desde México hasta el Sureste de Brasil. En Paraguay se observó muy raras veces: en tres ocasiones en Carapa y una sola vez en el departamento de Caaguazú.
Oiticella convergens (Herrich-Schäffer, [1855]) fig. 14
En el Sureste de Brasil y en Venezuela(!)(Lemaire, 1988). En Paraguay solo en la región oriental en la zona que una vez cubrió el Bosque Atlántico. Común en el Refugio.
Oiticella luteciae (Bouvier, 1924) fig. 13
Conocida solo del Sur de Brasil, de Misiones, Argentina, y de la región oriental del Paraguay. En Carapa es común y se encuentra regularmente.
Ptiloscola photophila (W. Rothschild, 1907)
Distribución amazónica desde Venezuela hasta Bolivia (Santa Cruz) y el Sureste de Brasil. En Paraguay solo en el Norte y Nordeste. En el área estudiada común.
Neorcarnegia basirei (Schaus, 1892) fig. 15
Al Sur de Amazonía hasta Bolivia (Santa Cruz), el sureste de Brasil y Paraguay. Solo dos veces fue observada en Carapa. Con mas frecuencia, pero nunca común, se encuentra en el área al oeste del Bosque Atlántico. Los estadios inmaduros fueron documentados en Drechsel & Lampe, 1996.
HEMILEUCINAE
Lonomia obliqua Walker, 1855
Conocida del Sureste y Sur de Brasil y de Uruguay. En el Paraguay pocos registros en la región oriental y en Carapa en una sola ocasión.
Periga circumstans Walker, 1855 fig. 26
La especie tiene una distribución que abarca el sureste de Brasil hasta el Norte de Argentina, incluyendo Paraguay y Uruguay.
En la reserva común. Las larvas solitarias fueron criadas exitosamente sobre Terminalia catappa (Combretaceae).
Periga falcata (Walker, 1855)
Su distribución se limita al Sureste de Brasil y a Uruguay. En el Paraguay se registró solamente en las reservas de Limoy y en Carapa en dos ocasiones.
Periga parvibulbacea (Lemaire, 1972)
Ecuador y Peru. En el Paraguay un solo registro en Carapa.
Automeris amoena (Boisduval, 1875) fig. 16
Desde Venezuela hasta Paraguay y Misiones, Argentina. Común en el este del país y en el Refugio.
Automeris hamata Schaus, 1906 fig. 17
Ampliamente distribuida desde Nicaragua hasta Brasil y Bolivia. En Paraguay se registró solamente en el Norte del Chaco, el Norte del departamento de Concepción y en una ocasión en Carapa.
Automeris basalis (Walker, 1855) fig. 18
Conocida solo de la Serra do Mar en el Sur de Brasil, desde los estados de Rio de Janeiro hasta Rio Grande do Sul. Su distribución en Paraguay se limita a los departamentos de Guairá, Alto Paraná y Kanindeyú (Refugio Biologico Carapa) donde se la observa con frecuencia. Las larvas fueron criadas hasta el tercer estadío con Bambusa sp. (Poaceae).
Automeris naranja Schaus, 1898 fig. 19 y 20
En todo el Sur de Brasil, Uruguay y en el Norte de Argentina. En Paraguay es la especie mas abundante del genero en la parte oriental del país. Gran diversidad de plantas forrajeras son aceptadas por las larvas, entre ellas: Allophylus edulis (Sapindaceae), Inga spp. (Fabaceae) y Bauhinia sp. (Fabaceae).
Leucanella memusae (Walker, 1855) fig. 23 y 24
La especie se divide en dos subespecies (Lemaire, 1971), una en el Nordeste de Brasil y la otra, L. memusae gardineri, en el Sur y en Paraguay. Aunque se encontró una sola vez en el Refugio, se la ve con frecuencia en otros departamentos.
Pseudautomeris luteata (Walker, 1865) fig. 27
Su distribución abarca el Centro y Sur de Brasil, el Norte de Argentina y la Región Oriental de Paraguay. En Carapa aparece regularmente, pero no en abundancia. Con Tabebuia heptaphylla (Bignoniaceae) las larvas fueron llevadas hasta el cuarto estadío.
Gamelia catharina (Draudt, 1929) fig. 21 y 22
Distribuida en el Sureste de Brasil, en Misiones (Argentina) y en Paraguay en toda la zona que una vez cubrió el Bosque Atlántico. En Carapa fue observada en una sola ocasión.
Hylesia scortina Draudt, 1929
Su distribución llega desde el Centro y Sur de Brasil hasta Misiones (Argentina) y la Región Oriental de Paraguay. En Carapa se encuentra con frecuencia.
Molippa nibasa Maassen & Weyding, 1885 fig. 25
Ampliamente distribuida desde México hasta Paraguay, donde es muy común en la parte oriental. Las larvas fueron exitosamente criadas con Cassia spp. (Fabaceae).
Dirphia avia (Stoll, 1780)
Desde Nicaragua hasta Bolivia, Brasil y la Región Oriental de Paraguay llega la distribución de esta especie. En el Refugio de Carapa fue observada dos veces. Las larvas fueron exitosamente alimentadas con Terminalia catappa (Combretaceae).
SATURNIINAE
Copaxa decrescens Walker, 1855 fig. 28
Esta especie tiene una distribución circum-amazonica, desde las Guyanas, Venezuela, Colombia, ecuador, Perú, Bolivia, el Sureste de Brasil hasta Misiones (Argentina) y el Este de Paraguay. En dos ocasiones se observó en Carapa. Las larvas fueron exitosamente criadas con Persea americana (Lauraceae).
Copaxa canella Walker, 1855 fig. 29
Distribuida desde el Nordeste hasta el Sur de Brasil. En Paraguay se registró solamente en el extremo Este del país, una vez en Carapa.
Copaxa flavina Draudt, 1929 fig. 30
Sureste y Sur de Brasil, Argentina (Provincia Misiones) y la Región Oriental de Paraguay. En una ocasión fue observada en el refugio.
Rothschildia jacobaeae (Walker, 1855) fig. 31
Su distribución abarca el Sur de Bolivia y Brasil, Uruguay y el Norte de Argentina. En Paraguay se encuentra en la parte este del país, a veces con frecuencia. En el área del estudio en una sola ocasión.
Rothschildia hopfferi (C. Felder & R. Felder, 1859) fig. 32
Conocida desde la región subandina de Perú y Bolivia y la zona que una vez cubrió el Bosque Atlántico en Brasil, Argentina y Paraguay. Una observación en Carapa.
Rothschildia arethusa (Walker, 1855) fig. 33
Restringido al Sudeste de Brasil, el Norte de Argentina (Misiones) y el Este de Paraguay. En el área del estudio en una sola ocasión.
Rothschildia aurota speculifera (Walker, 1855) fig. 34
Distribuida desde el Sudeste de Brasil hasta Uruguay y el Norte de Argentina. En Paraguay se encuentra en la Región Oriental y en dos ocasiones fue registrada en el refugio. Las larvas fueron exitosamente criadas con Ricinus communis (Euphorbiaceae).
SPHINGIDAE
SPHINGINAE
Agrius cingulatus (Fabricius, 1775) fig. 71
Amplia distribución desde Canadá hasta Argentina. Especie migratoria , que se encuentra en todo el Paraguay. Las larvas se alimentan de especies de la familia Convolvulaceae.
Cocytius duponchel (Poey, 1832) fig. 36
En toda la Neotropis, desde Costa Rica hasta Argentina y en todo el Paraguay. Las enormes orugas se encontró sobre Rollinia emarginata (Annonaceae).
Cocytius lucifer Rothschild & Jordan, 1903
Desde Centroamérica hasta Brasil y Paraguay. No existen todavía registro para el Chaco.
Neococytius cluentius (Cramer, 1775) fig. 43
Ampliamente distribuida desde el Sur de EE.UU. hasta Brasil y Paraguay.
Manduca sexta (Linnaeus, 1764) fig. 37
Su distribución abarca las dos Americas, desde Canadá hasta Argentina. En Paraguay es la especie mas abundante del genero. Las larvas se alimentan de diferente especies de Solanaceae y se encuentra frecuentemente sobre plantas de Tomate (Lycopersicum esculentum) y Tabaco (Nicotiana tabacum).
Manduca lucetius (Cramer, 1780) fig. 38
Distribuida desde Surinam hasta Argentina, encontrándose en todo el Paraguay.
Manduca diffissa (Butler, 1871) fig. 39
Desde Colombia y Venezuela hasta Paraguay y Argentina. La oruga se encontró sobre arbustos de Brunfelsia sp. (Solaneceae).
Manduca hannibal (Cramer, 1779)
En Centroamérica desde México (Veracruz) hasta el Sur de Brasil en Sudamérica. En Paraguay solo en la Región Oriental.
Manduca lefeburei (Guérin-Meneville, 1844) fig. 40
Desde México hasta el Sur de Brasil y el Este de Paraguay.
Manduca rustica (Fabricius, 1775) fig. 41
Ampliamente distribuida desde el Norte de EE.UU. hasta Argentina. En Paraguay común en todo el país, incluyendo el Chaco. La larva se encontró sobre Tabebuia sp. (Bignoniaceae).
Manduca florestan (Cramer, 1782) fig. 42
Desde el Sur de EE.UU. hasta Argentina (Misiones) y Paraguay, donde se encuentra en todo el país.
Protambulyx astygonus (Boisduval, [1875])
Distribución limitada al Sureste de Brasil y Paraguay, donde se observa en la Región Oriental.
Protambulyx strigilis (Linnaeus, 1771)
Su distribución abarca el Sur de EE.UU., las Islas del Caribe, Centroamérica y Sudamérica hasta Argentina. En Paraguay se encuentra comúnmente en toda la Región Oriental y en el este del Chaco.
Adhemarius gannascus (Stoll, 1790) fig. 35
Desde México hasta Argentina con subespecies en Cuba y Jamaica. En Paraguay en toda la parte este del país. Las larvas se encontró sobre Nectandra angustifolia (Lauraceae).
MACROGLOSSINAE
Erinnyis alope (Drury, 1770)
Ampliamente distribuida desde el Sur de EE.UU. hasta Argentina. En Paraguay en todo el país, incluyendo el Chaco.
Erinnyis lassauxi (Boisduval, 1859)
Desde el Sur de EE.UU. hasta el Norte de Argentina. En Paraguay en todo el país, especialmente abundante en el Chaco.
Erinnyis ello (Linnaeus, 1758) fig. 53
Su distribución abarca Norteamérica desde Canadá hasta Argentina en Sudamérica. En Paraguay en todas partes, la especie mas común de la familia. Las larvas se encuentra con frecuencia sobre plantas de Mandioca, Manihot esculenta (Euphorbiaceae).
Erinnyis oenotrus (Cramer, 1782) fig. 54
Desde el Sur de EE.UU. hasta el Norte de Argentina y Paraguay, donde se encuentra en todo el país. Las larvas se se encuentra sobre Tabernaemontana catharinensis (Apocynaceae) donde se mimetizan en color y forma con pequeñas ramas.
Erinnyis crameri (Schaus, 1898)
Comparte la distribución general con la especie anterior. En Paraguay es menos abundante en el Chaco.
Erinnyis obscura (Fabricius, 1775)
Desde el Centro de EE.UU. hasta el Norte de Argentina y Paraguay, donde es mas abundante en el Chaco. Las orugas forrajean sobre diferentes especies de la familia Asclepiadaceae
Phryxus caicus (Cramer, 1777) fig. 64
Desde el Sur de EE.UU. hasta el Norte de Argentina y Paraguay, donde se encuentra en todo el país.
Pachylia ficus (Linnaeus, 1758) fig. 61
Ampliamente distribuida desde el Sur de EE.UU. hasta Argentina. En Paraguay en todo el país. Las larvas se encuentra sobre Ficus spp. (Moraceae).
Pachylia syces Hübner, [1819]
Desde México hasta el Sur de Brasil y Paraguay. No se registró todavía para el Chaco. La oruga se encontró sobre Ficus sp.
Pachylioides resumens (Walker, 1856) fig. 62
Desde el Sur de EE.UU. hasta el Norte de Argentina y en todo el Paraguay, especialmente común en la Región Oriental.
Callionima nomius (Walker, 1856) fig. 45
En Centroamérica desde Guatemala hasta el Norte de Argentina (Misiones). En Paraguay solo en la Región Oriental.
Callionima parce (Fabricius, 1775) fig. 46
Desde el Sur de EE.UU. hasta el Norte de Argentina (Misiones) y Paraguay, donde se encuentra en todo el país. Las orugas forrajean sobre Tabernaemontana catharinensis (Apocynaceae)
Callionima inuus (Rothschild & Jordan, 1903) fig. 47 y 48
Desde México hasta el Norte de Argentina (Misiones) y Paraguay, muy común en el Este del país. Las larvas se encuentra con frecuencia sobre Tabernaemontana catharinensis (Apocynaceae).
Aleuron chloropterum (Perty, 1833)
En Centroamérica desde Guatemala hasta el Norte de Argentina. Debido a su actividad crepuscular existen pocos registros para el Paraguay y solamente en la Región Oriental. Estas mariposas no vienen a la luz artificial pero visitan flores durante el corto tiempo entre la puesta del sol y la oscuridad de la noche.
Enyo lugubris (Linnaeus, 1771) fig. 49
Ampliamente distribuida desde el Sur de EE.UU. hasta el Norte de Argentina. En Paraguay muy común en todo el país. Las larvas se encuentra con frecuencia sobre especies de la familia Vitaceae.
Enyo ocypete (Linnaeus, 1758) fig. 50
Desde el Sur de EE.UU. hasta el Norte de Argentina y en todo el Paraguay. Las orugas sobre las mismas plantas que la especie anterior.
Enyo gorgon (Cramer, 1777) fig. 51 y 52
Desde México hasta el Norte de Argentina (Misiones) y Paraguay, donde es común en el este del país. No hay registros para la parte seca del Chaco.
Nyceryx alophus (Boisduval, [1875]) fig. 59
Su distribución se limita al este y Sur de Brasil y el Este de Paraguay.
Nyceryx riscus (Schaus, 1890) fig. 60
Desde México hasta el Norte de Argentina (Misiones) y Paraguay, común en el Este del país. No existen registros para el Chaco.
Perigonia lusca (Fabricius, 1777) fig. 63
Su distribución general es similar a la de la especie anterior. En Paraguay se encuentra en todo el país.
Eupyrrhoglossum sagra (Poey, 1832) fig. 58
Desde México hasta el Sur de Brasil y el Este de Paraguay. Debido a su actividad crepuscular existen pocos registros para el Paraguay y solamente para la Región Oriental.
Aellopos tantalus (Linnaeus, 1758) fig. 44
Las cuatro especies de este genero registrados en Paraguay tienen una distribución muy amplia: desde el Sur de EE.UU. hasta el Norte de Argentina. Todas son diurnas y parecen ser migratorias. Por su similitud entre si no se puede identificar a simple vista. A. tantalus y la especie siguiente entraron en los edificios de la administración del refugio y atrapadas detrás de las ventanas se secaron rápidamente y así pudieron ser identificados.
Aellopos fadus (Cramer, 1776) fig. 44
Vea especie anterior.
Eumorpha satellitia (Linnaeus, 1771) fig. 72
Desde México hasta el Norte de Argentina. En Paraguay se encuentra en todo el país.
Eumorpha vitis (Linnaeus, 1758) fig. 55
Desde el Sur de EE.UU. hasta el Norte de Argentina y en todo el Paraguay. Las larvas se encuentra con frecuencia sobre especies de la familia Vitaceae.
Eumorpha fasciata (Sulzer, 1776) fig. 56
Amplia distribución desde Canadá hasta Argentina. En Paraguay se encuentra en todo el país. Las larvas forrajean sobre especies de la familia Vitaceae.
Eumorpha labruscae (Linnaeus, 1758) fig. 57
Desde el Sur de EE.UU. hasta el Norte de Argentina y en todo el Paraguay. Las larvas forrajean sobre especies de la familia Vitaceae.
Xylophanes pluto (Fabricius, 1777) fig. 65
Desde el Sur de EE.UU. hasta el Norte de Argentina. En Paraguay solo en el Este del país.
Xylophanes porcus (Hübner, [1823]) fig. 66
Desde el Sur de EE.UU. (Florida) hasta el Norte de Argentina (Misiones). En Paraguay solo en el Este del país.
Xylophanes ceratomioides (Grote & Robinson, 1967) fig. 67
Desde México hasta el Norte de Argentina (Misiones). En Paraguay solo en el Este del país.
Xylophanes chiron (Drury, 1771) fig. 68
Distribución general y en Paraguay idéntica a la de la especie anterior.
Xylophanes titana (Druce, 1878)
Desde México hasta el Sur de Brasil. En Paraguay solo en la Región Oriental.
Xylophanes tersa (Linnaeus, 1771) fig. 69 y 70
Ampliamente distribuida desde Canadá hasta Argentina. En Paraguay se encuentra en todo el país.
Xylophanes libya (Druce, 1878)
Desde México hasta Brasil. En Paraguay se encuentra en toda la zona que una vez cubrió el Bosque Atlántico.
| especies / fecha visita | iii. 1997 | iv. 1998 | xi. 1998 | iv. 1999 | viii.2000 | xi. 2003 | iii. 2005 | ix. 2006 |
| Arsenura armida | x | x | x | x | x | |||
| Arsenura xanthopus | x | x | x | x | ||||
| Dysdaemonia brasiliensis | x | x | x | |||||
| Dysdaemonia fosteri | x | x | x | x | ||||
| Citheronia laocoon | x | |||||||
| Schausiella arpi | x | |||||||
| Syssphinx molina | x | x | x | x | x | |||
| Adeloneivaia subangulata | x | x | x | x | x | x | ||
| Adeloneivaia acuta | x | x | x | x | x | |||
| Adelowalkeria flavosignata | x | x | x | x | x | x | x | x |
| Scolesa hypoxantha | x | x | ||||||
| Citioica anthonilis | x | x | x | |||||
| Oiticella convergens | x | x | x | x | x | x | ||
| Oiticella luteciae | x | x | x | x | x | x | x | |
| Ptiloscola photophila | x | x | x | x | ||||
| Neorcarnegia basirei | x | x | ||||||
| Lonomia obliqua | x | |||||||
| Periga circumstans | x | x | x | x | ||||
| Periga falcata | x | x | ||||||
| Periga parvibulbacea | x | |||||||
| Automeris amoena | x | x | x | |||||
| Automeris hamata | x | |||||||
| Automeris basalis | x | x | x | x | ||||
| Automeris naranja | x | x | x | x | ||||
| Leucanella memusae | x | |||||||
| Pseudautomeris luteata | x | x | x | x | ||||
| Gamelia catharina | x | |||||||
| Hylesia scortina | x | x | x | |||||
| Molippa nibasa | x | x | x | x | x | x | x | |
| Dirphia avia | x | x | ||||||
| Copaxa decrescens | x | x | ||||||
| Copaxa canella | x | |||||||
| Copaxa flavina | x | |||||||
| Rothschildia jacobaeae | x | |||||||
| Rothschildia hopfferi | x | |||||||
| Rothschildia arethusa | x | |||||||
| Rothschildia aurota | x | x | ||||||
| Total especies | 21spp. | 18 spp. | 19 spp. | 12 spp. | 12 spp. | 6 spp. | 15 spp. | 10 spp. |
Cuadro 1: Distribución temporal de las especies de SATURNIIDAE . Los rectángulos negros indican la presencia de la respectiva especie
| especies / fecha visita | iii. 1997 | iv. 1998 | xi. 1998 | iv. 1999 | viii.2000 | xi. 2003 | iii. 2005 | ix. 2006 |
| Agrius cingulatus | x | |||||||
| Cocytius duponchel | x | x | x | |||||
| Cocytius lucifer | x | |||||||
| Neococytius cluentius | x | x | ||||||
| Manduca sexta | x | x | x | |||||
| Manduca lucetius | x | x | ||||||
| Manduca diffissa | x | x | x | x | ||||
| Manduca hannibal | x | x | x | x | x | |||
| Manduca lefeburei | x | |||||||
| Manduca rustica | x | x | x | x | x | |||
| Manduca florestan | x | x | x | |||||
| Protambulyx astygonus | x | x | ||||||
| Protambulyx strigilis | x | x | x | x | ||||
| Adhemarius gannascus | x | x | x | x | x | x | x | |
| Erinnyis alope | x | x | x | x | x | x | ||
| Erinnyis lassauxi | x | x | ||||||
| Erinnyis ello | x | x | x | x | x | |||
| Erinnyis oenotrus | x | x | x | x | x | |||
| Erinnyis crameri | x | x | x | x | x | |||
| Erinnyis obscura | x | x | x | |||||
| Phryxus caicus | x | |||||||
| Pachylia ficus | x | x | ||||||
| Pachylia syces | x | |||||||
| Pachylioides resumens | x | x | x | x | x | x | x | x |
| Callionima nomius | x | x | x | x | ||||
| Callionima parce | x | x | x | x | x | |||
| Callionima inuus | x | x | x | x | x | x | ||
| Aleuron chloropterum | x | |||||||
| Enyo lugubris | x | x | x | x | x | x | ||
| Enyo ocypete | x | x | x | |||||
| Enyo gorgon | x | x | x | x | x | x | ||
| Nyceryx alophus | x | x | ||||||
| Nyceryx riscus | x | x | x | x | x | |||
| Perigonia lusca | ||||||||
| Eupyrrhoglossum sagra | x | |||||||
| Aellopos tantalus | x | |||||||
| Aellopos fadus | ||||||||
| Eumorpha satellitia | x | x | x | |||||
| Eumorpha vitis | x | |||||||
| Eumorpha fasciata | x | x | ||||||
| Eumorpha labruscae | x | x | x | x | ||||
| Xylophanes pluto | x | x | x | x | ||||
| Xylophanes porcus | x | x | x | x | x | |||
| Xylophanes ceratomioides | x | x | x | x | ||||
| Xylophanes chiron | x | x | x | x | x | |||
| Xylophanes titana | x | x | x | x | x | |||
| Xylophanes tersa | x | x | x | x | x | |||
| Xylophanes libya | x | x | x | x | x | |||
| Total especies | 29 spp. | 35 spp. | 24 spp. | 19 spp. | 7 spp. | 17 spp. | 21 spp. | 13 spp. |
Cuadro 2: Distribución temporal de las especies de SPHINGIDAE. Los rectángulos negros indican la presencia de la respectiva especie
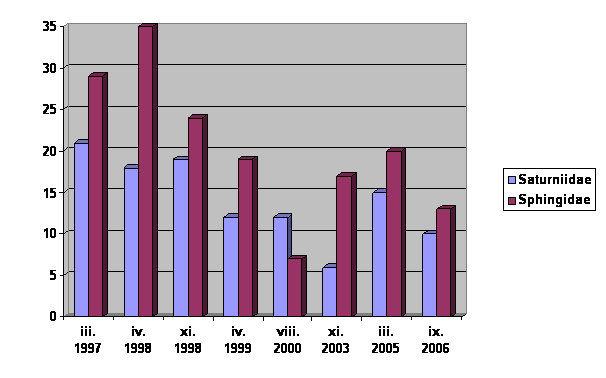
Aunque el bajo numero de especies en Agosto del año 2000 y Agosto - Setiembre 2006 se pudiera explicar con la temporada del invierno y las bajas temperaturas, el cuadro muestra claramente un declive en la diversidad desde 1997 hasta 2006.
 fig. 1 Arsenura armida |
 fig. 2 Arsenura xanthopus |
 fig. 3 Dysdaemonia brasiliensis |
 fig. 4 Dysdaemonia fosteri |
 fig. 5 Citheronia laocoon |
 fig. 6 Syssphinx molina ♂ |
 fig. 7 Syssphinx molina ♀ |
 fig. 8 Adeloneivaia subangulata ♂ |
 fig. 9 Adeloneivaia subangulata ♀ |
 fig. 10 Adelowalkeria flavosignata |
 fig. 11 Scolesa hypoxantha |
 fig. 12 Citioica anthonilis |
 fig. 13 Oiticella luteciae |
 fig. 14 Oiticella convergens |
 fig. 15 Neorcarnegia basirei |
 fig. 16 Automeris amoena |
 fig. 17 Automeris hamata |
 fig. 18 Automeris basalis |
 fig. 19 Automeris naranja ♂ |
 fig. 20 Automeris naranja ♀ |
 fig. 21 Gamelia catharina ♂ |
 fig. 22 Gamelia catharina ♂ |
 fig. 23 Leucanella memusae ♂ |
 fig. 24 Leucanella memusae ♀ |
 fig. 25 Molippa nibasa |
 fig. 26 Periga circumstans |
 fig. 27 Pseudautomeris luteata |
 fig. 28 Copaxa decrescens |
 fig. 29 Copaxa canella |
 fig. 30 Copaxa flavina |
 fig. 31 Rothschildia jacobaeae |
 fig. 32 Rothschildia hopfferi |
 fig. 33 Rothschildia arethusa |
 fig. 34 Rothschildia aurota |
 fig. 35 Adhemarius gannascus |
 fig. 36 Cocytius duponchel |
 fig. 37 Manduca sexta |
 fig. 38 Manduca lucetius |
 fig. 39 Manduca diffissa |
 fig. 40 Manduca lefeburei |
 fig. 41 Manduca rustica |
 fig. 42 Manduca florestan |
 fig. 43 Neococytius cluentius |
 fig. 44 Aellopos sp. |
 fig. 45 Callionima nomius |
 fig. 46 Callionima parce |
 fig. 47 Callionima inuus ♂ |
 fig. 48 Callionima inuus ♀ |
 fig. 49 Enyo lugubris ♀ |
 fig. 50 Enyo ocypete |
 fig. 51 Enyo gorgon ♂ |
 fig. 52 Enyo gorgon ♀ |
 fig. 53 Erinnyis ello ♂ |
 fig. 54 Erinnyis oenotrus |
 fig. 55 Eumorpha vitis |
 fig. 56 Eumorpha fasciata |
 fig. 57 Eumorpha labruscae |
 fig. 58 Eupyrrhoglossum sagra |
 fig. 59 Nyceryx alophus |
 fig. 60 Nyceryx riscus |
 fig. 61 Pachylia ficus |
 fig. 62 Pachylioides resumens |
 fig. 63 Perigonia lusca |
 fig. 64 Phryxus caicus |
 fig. 65 Xylophanes pluto |
 fig. 66 Xylophanes porcus |
 fig. 67 Xylophanes ceratomioides |
 fig. 68 Xylophanes chiron |
 fig. 69 Xylophanes tersa |
 fig. 70 Xylophanes tersa |
 fig. 71 Agrius cingulatus |
 fig. 72 Eumorpha satellitia |
AGRADECIMIENTOS
Agradezco a la Itaipu Binacional en la persona de su Director General al Dr. Víctor Bernal, y a los funcionarios del Medio Ambiente por los permisos otorgados. A Nelson Pérez, quien amablemente facilitó datos técnicos y a Jorge Escobar por su apoyo durante los trabajos de campo.
LITERATURA CITADA
BECKER, V.O., R.H. CARCASSON, J.B. HEPPNER & C. LEMAIRE, 1996. Atlas of Neotropical Lepidoptera. Checklist: Part 4B. Drepanoidea - Bombycoidea - Sphingoidea. 87pp.
D´ABRERA, B. 1986. Sphingidae Mundi. Hawkmoths of the world. Faringdon (Classey).
DRECHSEL, U., 1994. Beitrag zur Kenntnis der Sphingidenfauna von Paraguay (Lepidoptera: Sphingidae). Entomologische Zeitschrift 104(14): 265-276.
DRECHSEL, U., 1995. Die Cordillera del Yvytyrusu in Paraguay, ein Refugialraum für mehrere disjunkt verbreitete Saturniiden-Arten (Lepidoptera: Saturniidae). Entomologische Zeitschrift 105(14): 269-278.
DRECHSEL, U. & R. LAMPE, 1996. Die Praeimaginalstadien von Neorcarnegia basirei (Schaus, 1892) mit Anmerkungen zur Biogeographie (Lepidoptera: Saturniidae, Ceratocampinae). Nachr. Entomol. Ver. Apollo, N.F.17(2): 143-152
LEMAIRE, C., 1972. Révision du genre Lonomia Walker (Lep. Attacidae). Ann. Soc. Ent. Fr. (N.S.)8 (4): 767-861
LEMAIRE, C., 1973. Révision du genre Automeris et des genres voisins. Mém. Mus. natn. Hist. nat., Sér. A, 79.
LEMAIRE, C., 1978. Les Attacidae americains. Attacinae. Ed. C. Lemaire.
LEMAIRE, C., 1980. Les Attacidae americains. Arsenurinae. Ed. C. Lemaire.
LEMAIRE, C., 1988. Les Saturniidae americains. Ceratocampinae. San Jose (Museo Nacional de Costa Rica).
RACHELI, L., 1995. Note sui Saturnidi del Paraguay e Descrizione della femmina di Scolesa hypoxantha (Lepidoptera: Saturniidae). Fragmenta Entomologica, Roma, 27(1): 145-154.
SCHADE, F., 1927. Entomologische Skizzen aus Paraguay. IV. Sphingiden. Entomologische Rundschau 44(5-6).
SCHADE, F., 1928. Die Kolonie Independentia (sic!) als Sammelgebiet. Entomologische Rundschau
45(2): 6.